
Cargando...
¿Qué puedo hacer?
tipo de documento Lecciones
En física y química se observa que, para cualquier sustancia o mezcla, modificando sus condiciones de temperatura o presión, pueden obtenerse distintos estados o fases, denominados estados de agregación de la materia, en relación con las fuerzas de unión de las partículas (moléculas, átomos o iones) que la constituyen.

odos los estados de agregación poseen propiedades y características diferentes; los más conocidos y observables cotidianamente son cuatro, llamados fases sólida, líquida, gaseosa y plasmática. También son posibles otros estados que no se producen de forma natural en nuestro entorno, por ejemplo: condensado de Bose-Einstein, condensado fermiónico y estrellas de neutrones. Se cree que también son posibles otros, como el plasma de quarks-gluones.
El término «fase» se utiliza a veces como sinónimo de estado de la materia, pero un sistema puede contener varias fases «inmiscibles» del mismo estado de la materia.
El sólido (del latín solĭdus) es un estado de agregación de la materia, que se caracteriza porque opone resistencia a cambios de forma y de volumen. Sus partículas se encuentran juntas y también se ven correctamente ordenadas. Las moléculas de un sólido tienen una gran cohesión y adoptan formas bien definidas. Existen varias disciplinas que estudian los sólidos:
Manteniendo constante la presión a baja temperatura los cuerpos se presentan en forma sólida y encontrándose entrelazados formando generalmente estructuras cristalinas. Esto confiere al cuerpo la capacidad de soportar fuerzas sin deformación aparente.
El sólido más ligero conocido es un material artificial, el aerogel con una densidad de 3 mg/cm³ o 3 kg/m³, el vidrio, que tiene una densidad de 1,9 g/cm³, mientras que el más denso es un metal, el osmio (Os), que tiene una densidad de 22,6 g/cm³.
Propiedades de un sólido
Los objetos en estado sólido se presentan como cuerpos de forma definida; sus átomos a menudo se entrelazan formando estructuras estrechas definidas, lo que les confiere la capacidad de soportar fuerzas sin deformación aparente. Son calificados generalmente como duros así como resistentes, y en ellos las fuerzas de atracción son mayores que las de repulsión.

En los sólidos cristalinos, la presencia de espacios intermoleculares pequeños da paso a la intervención de las fuerzas de enlace, que ubican a las celdillas en formas geométricas. En los amorfos o vítreos, por el contrario, las partículas que los constituyen carecen de una estructura ordenada.
Las sustancias en estado sólido suelen presentar algunas de las siguientes características:
En los sólidos cristalinos, las partículas (átomos, moléculas o iones) están empaquetadas en un patrón repetitivo y regularmente ordenado. Hay varias estructuras cristalinas diferentes, y una misma sustancia puede tener más de una estructura (o fase sólida). Por ejemplo, el hierro tiene una estructura cúbica centrada en el cuerpo a temperaturas inferiores a 912 °C (1.674 °F), y una estructura cúbica centrada en la cara entre 912 y 1.394 °C (2.541 °F). El hielo tiene quince estructuras cristalinas conocidas, o quince fases sólidas, que existen a distintas temperaturas y presiones.
Los vidrios y otros sólidos no cristalinos y amorfos sin orden de largo alcance no son estados básicos de equilibrio térmico, por lo que se describen a continuación como «estados no clásicos de la materia».
Los sólidos pueden transformarse en líquidos por fusión, y los líquidos pueden transformarse en sólidos por congelación. Los sólidos también pueden transformarse directamente en gases mediante el proceso de sublimación, y los gases pueden igualmente transformarse directamente en sólidos mediante la deposición.
Elasticidad: Un sólido recupera su forma original cuando es deformado.6Un resorte es un objeto en que podemos observar esta propiedad ya que vuelve a su forma original.
Fragilidad: Un sólido puede romperse en muchos fragmentos (quebradizo).7
Dureza: La dureza es la oposición que ofrecen los materiales a alteraciones como la penetración, la abrasión, el rayado, la cortadura, y las deformaciones permanentes entre otras.. El diamante es un sólido con dureza elevada.
Forma definida: Tienen forma definida, son relativamente rígidos y no fluyen como lo hacen los gases y los líquidos, excepto bajo presiones extremas del medio.
Alta densidad: Los sólidos tienen densidades relativamente altas debido a la cercanía de sus moléculas por eso se dice que son más “pesados”

Flotación: Algunos sólidos cumplen con esta propiedad, solo si su densidad es menor a la del líquido en el cual se coloca.
Inercia: es la dificultad o resistencia que opone un sistema físico o un sistema social a posibles cambios, en el caso de los sólidos pone resistencia a cambiar su estado de reposo.
Tenacidad: En ciencia de los Materiales la tenacidad es la resistencia que opone un material a que se propaguen fisuras o grietas.
Maleabilidad: Es la propiedad de la materia, que presentan los cuerpos a ser labrados por deformación. La maleabilidad permite la obtención de delgadas láminas de material sin que este se rompa, teniendo en común que no existe ningún método para cuantificarlas.
Ductilidad: La ductilidad se refiere a la propiedad de los sólidos de poder obtener hilos de ellos.
Rigidez: Algunos sólidos pueden resistir más que otros los dobleces y torceduras.
Deformación: Algunos sólidos pueden deformarse sin romperse, adquiriendo una forma diferente a la que tenían.
Aleabilidad: Propiedad que tienen los materiales para formar aleaciones que dan lugar a nuevos materiales mejorando sus prestaciones.
Calor específico: La capacidad calorífica de una sustancia es la energía necesaria para aumentar 1℃ su temperatura
Estado líquido
El líquido es un estado de agregación de la materia en forma de fluido altamente incompresible, lo que significa que su volumen es casi constante en un rango grande de presión. Es el único estado con un volumen definido, pero no con forma fija. Un líquido está formado por pequeñas partículas vibrantes de la materia, como los átomos y las moléculas, unidas por enlaces intermoleculares.
Si bien el agua es, el líquido más común en la Tierra, además del más abundante, este estado de la materia es en realidad el menos común en el universo conocido, porque los líquidos requieren un rango de temperatura/presión relativamente estrecho para existir. La mayor parte de la materia conocida en el universo está en forma gaseosa (con rastros de materia sólida detectable) como nubes interestelares o como plasma en el interior de las estrellas.

Al igual que un gas, un líquido es capaz de fluir y tomar la forma de un recipiente. A diferencia de un gas, un líquido no se dispersa para llenar cada espacio de un contenedor, pero si mantiene una densidad constante. La densidad de un líquido suele ser cercana a la de un sólido y mucho más alta que la de un gas. Por lo tanto, tanto el líquido como el sólido se denominan materia condensada. Una característica distintiva del estado líquido es la tensión superficial, dando lugar a fenómenos humectantes.
Si se incrementa la temperatura de un sólido, este va perdiendo forma hasta desaparecer la estructura cristalina, alcanzando el estado líquido. Característica principal: la capacidad de fluir y adaptarse a la forma del recipiente que lo contiene. En este caso, aún existe cierta unión entre los átomos del cuerpo, aunque mucho menos intensa que en los sólidos. El estado líquido presenta las siguientes características:
El estado líquido es un estado de agregación de la materia intermedio entre el estado sólido y el estado de gas. Las moléculas de los líquidos no están tan próximas como las de los sólidos, pero están menos separadas que las de los gases. Las moléculas en el estado líquido ocupan posiciones al azar que varían con el tiempo. Las distancias íntermoleculares son constantes dentro de un estrecho margen. En algunos líquidos, las moléculas tienen una orientación preferente, lo que hace que el líquido presente propiedades anisótropas (propiedades, como el índice de refracción, que varían según la dirección dentro del material).
Los líquidos presentan tensión superficial y capilaridad, generalmente se dilatan cuando se incrementa su temperatura y pierden volumen cuando se enfrían, aunque sometidos a compresión su volumen es muy poco variable a diferencia de lo que sucede con otros fluidos como los gases. Los objetos inmersos en algún líquido están sujetos a un fenómeno conocido como flotabilidad.
Estado Líquido
Su forma es esférica si sobre él no actúa ninguna fuerza externa. Por ejemplo, una gota de agua en caída libre toma la forma esférica.5
Como fluido sujeto a la fuerza de la gravedad, la forma de un líquido queda definida por su contenedor. En un líquido en reposo sujeto a la gravedad, en cualquier punto de su seno existe una presión de igual magnitud hacia todos los lados, tal como establece el principio de Pascal. Si un líquido se encuentra en reposo, la presión hidrostática en cualquier punto del mismo viene dada por: \({\displaystyle p=\rho gz\,}\)
Donde \({\displaystyle \rho }\) es la densidad del líquido, \({\displaystyle g}\) es la gravedad (9,8 m/s) y \({\displaystyle z}\) es la distancia del punto considerado a la superficie libre del líquido en reposo. En un fluido en movimiento la presión no necesariamente es isótropa, porque a la presión hidrostática se suma la presión hidrodinámica que depende de la velocidad del fluido en cada punto.
Cambios de estado
En condiciones apropiadas de temperatura y presión, la mayoría de las sustancias pueden existir en estado líquido. Cuando un líquido sobrepasa su punto de ebullición cambia su estado a gaseoso, y cuando alcanza su punto de congelación cambia a sólido. Aunque a presión atmosférica, sin embargo, algunos sólidos se subliman al calentarse; es decir, pasan directamente del estado sólido al estado gaseoso (véase evaporación). La densidad de los líquidos suele ser algo menor que la densidad de la misma sustancia en estado sólido. Algunas sustancias, como el agua, son más densas en estado líquido.
Por medio de la destilación fraccionada, los líquidos pueden separarse de entre sí al evaporarse cada uno al alcanzar sus respectivos puntos de ebullición. La cohesión entre las moléculas de un líquido no es lo suficientemente fuerte por lo que las moléculas superficiales se pueden evaporar.

Estado gaseoso
Se denomina gas al estado de agregación de la materia compuesto principalmente por moléculas no unidas, expandidas y con poca fuerza de atracción, lo que hace que los gases no tengan volumen definido ni forma definida, y se expandan libremente hasta llenar el recipiente que los contiene. Su densidad es mucho menor que la de los líquidos y sólidos, y las fuerzas gravitatorias y de atracción entre sus moléculas resultan insignificantes. En algunos diccionarios el término gas es considerado como sinónimo de vapor, aunque no hay que confundir sus conceptos: vapor se refiere estrictamente a aquel gas que se puede condensar por presurización a temperatura constante.
Dependiendo de sus contenidos de energía o de las fuerzas que actúan, la materia puede estar en un estado o en otro diferente: se ha hablado durante la historia, de un gas ideal o de un sólido cristalino perfecto, pero ambos son modelos límites ideales y, por tanto, no tienen existencia real.
En un gas, las moléculas están en estado de caos y muestran poca respuesta a la gravedad. Se mueven tan rápidamente que se liberan unas de otras. Ocupan entonces un volumen mucho mayor que en los otros estados porque dejan espacios libres intermedios y están enormemente separadas unas de otras. Por eso es tan fácil comprimir un gas, lo que significa, en este caso, disminuir la distancia entre moléculas. El gas carece de forma y de volumen, porque se comprende que donde tenga espacio libre allí irán sus moléculas errantes y el gas se expandirá hasta llenar por completo cualquier recipiente.

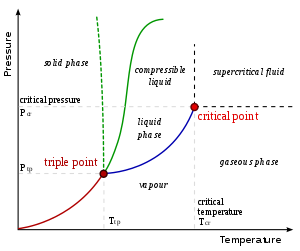
A temperaturas inferiores a su temperatura crítica, un gas también se denomina vapor y puede licuarse sólo por compresión sin necesidad de refrigeración. Un vapor puede existir en equilibrio con un líquido (o sólido), en cuyo caso la presión del gas es igual a la presión de vapor del líquido (o sólido).
Un fluido supercrítico (SCF) es un gas cuya temperatura y presión están por encima de la temperatura y la presión críticas, respectivamente. En este estado, la distinción entre líquido y gas desaparece. Un fluido supercrítico tiene las propiedades físicas de un gas, pero su alta densidad le confiere propiedades de disolvente en algunos casos, lo que da lugar a aplicaciones útiles. Por ejemplo, el dióxido de carbono supercrítico se utiliza para extraer cafeína en la fabricación de café descafeinado.
Texto:
Imagen:
En física y química se observa que, para cualquier sustancia o mezcla, modificando sus condiciones de temperatura o presión, pueden obtenerse distintos estados o fases, denominados estados de agregación de la materia, en relación con las fuerzas de unión de las partículas (moléculas, átomos o iones) que la constituyen.

odos los estados de agregación poseen propiedades y características diferentes; los más conocidos y observables cotidianamente son cuatro, llamados fases sólida, líquida, gaseosa y plasmática. También son posibles otros estados que no se producen de forma natural en nuestro entorno, por ejemplo: condensado de Bose-Einstein, condensado fermiónico y estrellas de neutrones. Se cree que también son posibles otros, como el plasma de quarks-gluones.
El término «fase» se utiliza a veces como sinónimo de estado de la materia, pero un sistema puede contener varias fases «inmiscibles» del mismo estado de la materia.
El sólido (del latín solĭdus) es un estado de agregación de la materia, que se caracteriza porque opone resistencia a cambios de forma y de volumen. Sus partículas se encuentran juntas y también se ven correctamente ordenadas. Las moléculas de un sólido tienen una gran cohesión y adoptan formas bien definidas. Existen varias disciplinas que estudian los sólidos:
Manteniendo constante la presión a baja temperatura los cuerpos se presentan en forma sólida y encontrándose entrelazados formando generalmente estructuras cristalinas. Esto confiere al cuerpo la capacidad de soportar fuerzas sin deformación aparente.
El sólido más ligero conocido es un material artificial, el aerogel con una densidad de 3 mg/cm³ o 3 kg/m³, el vidrio, que tiene una densidad de 1,9 g/cm³, mientras que el más denso es un metal, el osmio (Os), que tiene una densidad de 22,6 g/cm³.
Propiedades de un sólido
Los objetos en estado sólido se presentan como cuerpos de forma definida; sus átomos a menudo se entrelazan formando estructuras estrechas definidas, lo que les confiere la capacidad de soportar fuerzas sin deformación aparente. Son calificados generalmente como duros así como resistentes, y en ellos las fuerzas de atracción son mayores que las de repulsión.

En los sólidos cristalinos, la presencia de espacios intermoleculares pequeños da paso a la intervención de las fuerzas de enlace, que ubican a las celdillas en formas geométricas. En los amorfos o vítreos, por el contrario, las partículas que los constituyen carecen de una estructura ordenada.
Las sustancias en estado sólido suelen presentar algunas de las siguientes características:
En los sólidos cristalinos, las partículas (átomos, moléculas o iones) están empaquetadas en un patrón repetitivo y regularmente ordenado. Hay varias estructuras cristalinas diferentes, y una misma sustancia puede tener más de una estructura (o fase sólida). Por ejemplo, el hierro tiene una estructura cúbica centrada en el cuerpo a temperaturas inferiores a 912 °C (1.674 °F), y una estructura cúbica centrada en la cara entre 912 y 1.394 °C (2.541 °F). El hielo tiene quince estructuras cristalinas conocidas, o quince fases sólidas, que existen a distintas temperaturas y presiones.
Los vidrios y otros sólidos no cristalinos y amorfos sin orden de largo alcance no son estados básicos de equilibrio térmico, por lo que se describen a continuación como «estados no clásicos de la materia».
Los sólidos pueden transformarse en líquidos por fusión, y los líquidos pueden transformarse en sólidos por congelación. Los sólidos también pueden transformarse directamente en gases mediante el proceso de sublimación, y los gases pueden igualmente transformarse directamente en sólidos mediante la deposición.
Elasticidad: Un sólido recupera su forma original cuando es deformado.6Un resorte es un objeto en que podemos observar esta propiedad ya que vuelve a su forma original.
Fragilidad: Un sólido puede romperse en muchos fragmentos (quebradizo).7
Dureza: La dureza es la oposición que ofrecen los materiales a alteraciones como la penetración, la abrasión, el rayado, la cortadura, y las deformaciones permanentes entre otras.. El diamante es un sólido con dureza elevada.
Forma definida: Tienen forma definida, son relativamente rígidos y no fluyen como lo hacen los gases y los líquidos, excepto bajo presiones extremas del medio.
Alta densidad: Los sólidos tienen densidades relativamente altas debido a la cercanía de sus moléculas por eso se dice que son más “pesados”

Flotación: Algunos sólidos cumplen con esta propiedad, solo si su densidad es menor a la del líquido en el cual se coloca.
Inercia: es la dificultad o resistencia que opone un sistema físico o un sistema social a posibles cambios, en el caso de los sólidos pone resistencia a cambiar su estado de reposo.
Tenacidad: En ciencia de los Materiales la tenacidad es la resistencia que opone un material a que se propaguen fisuras o grietas.
Maleabilidad: Es la propiedad de la materia, que presentan los cuerpos a ser labrados por deformación. La maleabilidad permite la obtención de delgadas láminas de material sin que este se rompa, teniendo en común que no existe ningún método para cuantificarlas.
Ductilidad: La ductilidad se refiere a la propiedad de los sólidos de poder obtener hilos de ellos.
Rigidez: Algunos sólidos pueden resistir más que otros los dobleces y torceduras.
Deformación: Algunos sólidos pueden deformarse sin romperse, adquiriendo una forma diferente a la que tenían.
Aleabilidad: Propiedad que tienen los materiales para formar aleaciones que dan lugar a nuevos materiales mejorando sus prestaciones.
Calor específico: La capacidad calorífica de una sustancia es la energía necesaria para aumentar 1℃ su temperatura
Estado líquido
El líquido es un estado de agregación de la materia en forma de fluido altamente incompresible, lo que significa que su volumen es casi constante en un rango grande de presión. Es el único estado con un volumen definido, pero no con forma fija. Un líquido está formado por pequeñas partículas vibrantes de la materia, como los átomos y las moléculas, unidas por enlaces intermoleculares.
Si bien el agua es, el líquido más común en la Tierra, además del más abundante, este estado de la materia es en realidad el menos común en el universo conocido, porque los líquidos requieren un rango de temperatura/presión relativamente estrecho para existir. La mayor parte de la materia conocida en el universo está en forma gaseosa (con rastros de materia sólida detectable) como nubes interestelares o como plasma en el interior de las estrellas.

Al igual que un gas, un líquido es capaz de fluir y tomar la forma de un recipiente. A diferencia de un gas, un líquido no se dispersa para llenar cada espacio de un contenedor, pero si mantiene una densidad constante. La densidad de un líquido suele ser cercana a la de un sólido y mucho más alta que la de un gas. Por lo tanto, tanto el líquido como el sólido se denominan materia condensada. Una característica distintiva del estado líquido es la tensión superficial, dando lugar a fenómenos humectantes.
Si se incrementa la temperatura de un sólido, este va perdiendo forma hasta desaparecer la estructura cristalina, alcanzando el estado líquido. Característica principal: la capacidad de fluir y adaptarse a la forma del recipiente que lo contiene. En este caso, aún existe cierta unión entre los átomos del cuerpo, aunque mucho menos intensa que en los sólidos. El estado líquido presenta las siguientes características:
El estado líquido es un estado de agregación de la materia intermedio entre el estado sólido y el estado de gas. Las moléculas de los líquidos no están tan próximas como las de los sólidos, pero están menos separadas que las de los gases. Las moléculas en el estado líquido ocupan posiciones al azar que varían con el tiempo. Las distancias íntermoleculares son constantes dentro de un estrecho margen. En algunos líquidos, las moléculas tienen una orientación preferente, lo que hace que el líquido presente propiedades anisótropas (propiedades, como el índice de refracción, que varían según la dirección dentro del material).
Los líquidos presentan tensión superficial y capilaridad, generalmente se dilatan cuando se incrementa su temperatura y pierden volumen cuando se enfrían, aunque sometidos a compresión su volumen es muy poco variable a diferencia de lo que sucede con otros fluidos como los gases. Los objetos inmersos en algún líquido están sujetos a un fenómeno conocido como flotabilidad.

Estado Líquido
Su forma es esférica si sobre él no actúa ninguna fuerza externa. Por ejemplo, una gota de agua en caída libre toma la forma esférica.5
Como fluido sujeto a la fuerza de la gravedad, la forma de un líquido queda definida por su contenedor. En un líquido en reposo sujeto a la gravedad, en cualquier punto de su seno existe una presión de igual magnitud hacia todos los lados, tal como establece el principio de Pascal. Si un líquido se encuentra en reposo, la presión hidrostática en cualquier punto del mismo viene dada por: \({\displaystyle p=\rho gz\,}\)
Donde \({\displaystyle \rho }\) es la densidad del líquido, \({\displaystyle g}\) es la gravedad (9,8 m/s) y \({\displaystyle z}\) es la distancia del punto considerado a la superficie libre del líquido en reposo. En un fluido en movimiento la presión no necesariamente es isótropa, porque a la presión hidrostática se suma la presión hidrodinámica que depende de la velocidad del fluido en cada punto.
Cambios de estado
En condiciones apropiadas de temperatura y presión, la mayoría de las sustancias pueden existir en estado líquido. Cuando un líquido sobrepasa su punto de ebullición cambia su estado a gaseoso, y cuando alcanza su punto de congelación cambia a sólido. Aunque a presión atmosférica, sin embargo, algunos sólidos se subliman al calentarse; es decir, pasan directamente del estado sólido al estado gaseoso (véase evaporación). La densidad de los líquidos suele ser algo menor que la densidad de la misma sustancia en estado sólido. Algunas sustancias, como el agua, son más densas en estado líquido.
Por medio de la destilación fraccionada, los líquidos pueden separarse de entre sí al evaporarse cada uno al alcanzar sus respectivos puntos de ebullición. La cohesión entre las moléculas de un líquido no es lo suficientemente fuerte por lo que las moléculas superficiales se pueden evaporar.

Estado gaseoso
Se denomina gas al estado de agregación de la materia compuesto principalmente por moléculas no unidas, expandidas y con poca fuerza de atracción, lo que hace que los gases no tengan volumen definido ni forma definida, y se expandan libremente hasta llenar el recipiente que los contiene. Su densidad es mucho menor que la de los líquidos y sólidos, y las fuerzas gravitatorias y de atracción entre sus moléculas resultan insignificantes. En algunos diccionarios el término gas es considerado como sinónimo de vapor, aunque no hay que confundir sus conceptos: vapor se refiere estrictamente a aquel gas que se puede condensar por presurización a temperatura constante.
Dependiendo de sus contenidos de energía o de las fuerzas que actúan, la materia puede estar en un estado o en otro diferente: se ha hablado durante la historia, de un gas ideal o de un sólido cristalino perfecto, pero ambos son modelos límites ideales y, por tanto, no tienen existencia real.
En un gas, las moléculas están en estado de caos y muestran poca respuesta a la gravedad. Se mueven tan rápidamente que se liberan unas de otras. Ocupan entonces un volumen mucho mayor que en los otros estados porque dejan espacios libres intermedios y están enormemente separadas unas de otras. Por eso es tan fácil comprimir un gas, lo que significa, en este caso, disminuir la distancia entre moléculas. El gas carece de forma y de volumen, porque se comprende que donde tenga espacio libre allí irán sus moléculas errantes y el gas se expandirá hasta llenar por completo cualquier recipiente.

A temperaturas inferiores a su temperatura crítica, un gas también se denomina vapor y puede licuarse sólo por compresión sin necesidad de refrigeración. Un vapor puede existir en equilibrio con un líquido (o sólido), en cuyo caso la presión del gas es igual a la presión de vapor del líquido (o sólido).
Un fluido supercrítico (SCF) es un gas cuya temperatura y presión están por encima de la temperatura y la presión críticas, respectivamente. En este estado, la distinción entre líquido y gas desaparece. Un fluido supercrítico tiene las propiedades físicas de un gas, pero su alta densidad le confiere propiedades de disolvente en algunos casos, lo que da lugar a aplicaciones útiles. Por ejemplo, el dióxido de carbono supercrítico se utiliza para extraer cafeína en la fabricación de café descafeinado.
Texto:
Imagen:
Contenido exclusivo para miembros de
Mira un ejemplo de lo que te pierdes
Categorías:
Etiquetas:
¿Quieres comentar? Regístrate o inicia sesión
Si ya eres usuario, Inicia sesión
Añadir a Didactalia Arrastra el botón a la barra de marcadores del navegador y comparte tus contenidos preferidos. Más info...
Comentar
0