
Cargando...
¿Qué puedo hacer?
Acerca de este recurso...
La Química del carbono es la parte de la química que estudia sustancias compuestas casi en su totalidad de carbono e hidrógeno, y que a veces contienen pequeñas cantidades de otros elementos, como oxígeno, nitrógeno, azufre o halógenos. Estos compuestos se denominan compuestos orgánicos porque se encuentran sobre todo en los seres vivos, y la parte de la Química que se ocupa de su estudio se denomina Química Orgánica.El número de compuestos en los que entra a formar parte el átomo de carbono es casi innumerable, y cada año se descubren varios miles más. Se encuentra en proteínas, hormonas, vitaminas, plásticos, antibióticos, perfumes, detergentes, etc.
Algunos de los productos orgánicos que hoy manejamos se conocían en la antigüedad; los fenicios y egipcios extraían colorantes de plantas y moluscos (púrpura) y ciertas sustancias medicinales. También conocían la conversión de la grasa animal en jabón y obtenían alcohol por fermentación de azúcares.  Hasta que en 1828, el químico alemán Fiedrich Wohler, logró sintetizar la urea a partir de materiales inorgánicos, se creía que los compuestos orgánicos solo podían producirse por la acción de una "fuerza vital" que únicamente poseían los seres vivos. A partir de entonces se han sintetizado cientos de miles de compuestos orgánicos
Hasta que en 1828, el químico alemán Fiedrich Wohler, logró sintetizar la urea a partir de materiales inorgánicos, se creía que los compuestos orgánicos solo podían producirse por la acción de una "fuerza vital" que únicamente poseían los seres vivos. A partir de entonces se han sintetizado cientos de miles de compuestos orgánicos  Kekulé, Le Bel, Van't Hoff y otros, entre 1850 y 1872, han desarrollado el concepto de enlace químico logrando representar las estructuras tridimensionales de las moléculas. En la actualidad se conocen varios millones de compuestos orgánicos diferentes y el ritmo de crecimiento es de más de cincuenta mil nuevos compuestos por año. Pero, ¿cuál es la causa de tal abundancia de compuestos del carbono?Se debe a la peculiar configuración electrónica del átomo de carbono y a la gran estabilidad de los enlaces covalentes que forma.
Kekulé, Le Bel, Van't Hoff y otros, entre 1850 y 1872, han desarrollado el concepto de enlace químico logrando representar las estructuras tridimensionales de las moléculas. En la actualidad se conocen varios millones de compuestos orgánicos diferentes y el ritmo de crecimiento es de más de cincuenta mil nuevos compuestos por año. Pero, ¿cuál es la causa de tal abundancia de compuestos del carbono?Se debe a la peculiar configuración electrónica del átomo de carbono y a la gran estabilidad de los enlaces covalentes que forma.
El carbono tiene un número atómico de seis, lo que significa que tiene seis protones en el núcleo y seis electrones en la corteza y su configuración electrónica es: 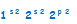 Siguiendo el principio de máxima multiplicidad de Hund podemos representar la configuración como:
Siguiendo el principio de máxima multiplicidad de Hund podemos representar la configuración como: 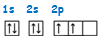 Esta configuración justifica una covalencia 2 para el carbono. A pesar de esto, el carbono sólo presenta la covalencia 2 en el monóxido de carbono. El carbono presenta covalencia 4 y esto sucede porque uno de los dos electrones 2s capta energía y salta al orbital 2pz en el subnivel 2p.
Esta configuración justifica una covalencia 2 para el carbono. A pesar de esto, el carbono sólo presenta la covalencia 2 en el monóxido de carbono. El carbono presenta covalencia 4 y esto sucede porque uno de los dos electrones 2s capta energía y salta al orbital 2pz en el subnivel 2p. 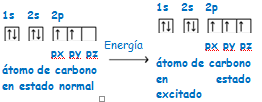 La configuración: 1s2 2s1 2p3, para el átomo de carbono explica su tetravalencia. Por tanto, el átomo de carbono puede formar cuatro enlaces covalentes para completar los ocho electrones de su capa más externa. Estos enlaces pueden ser de tres tipos: enlace simple, enlace doble y enlace triple. Enlace simple:
La configuración: 1s2 2s1 2p3, para el átomo de carbono explica su tetravalencia. Por tanto, el átomo de carbono puede formar cuatro enlaces covalentes para completar los ocho electrones de su capa más externa. Estos enlaces pueden ser de tres tipos: enlace simple, enlace doble y enlace triple. Enlace simple:  Es la manera más sencilla en la que el carbono comparte sus cuatro electrones. Los enlaces se colocan apuntando a los cuatro vértices de un tetraedro regular, estando el carbono en el baricentro de dicho tetraedro. Se dice que el carbono actúa de manera tetragonal.
Es la manera más sencilla en la que el carbono comparte sus cuatro electrones. Los enlaces se colocan apuntando a los cuatro vértices de un tetraedro regular, estando el carbono en el baricentro de dicho tetraedro. Se dice que el carbono actúa de manera tetragonal.
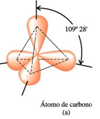 El ejemplo más simple lo representa el metano, en el que un átomo de carbono comparte cada uno de sus cuatro electrones exteriores con un átomo de hidrógeno, de modo que tanto el carbono como cada uno de los cuatro hidrógenos completan su última capa electrónica.Pero el átomo de carbono puede formar enlaces con otros átomos de carbono, originando cadenas que pueden ser larguísimas.
El ejemplo más simple lo representa el metano, en el que un átomo de carbono comparte cada uno de sus cuatro electrones exteriores con un átomo de hidrógeno, de modo que tanto el carbono como cada uno de los cuatro hidrógenos completan su última capa electrónica.Pero el átomo de carbono puede formar enlaces con otros átomos de carbono, originando cadenas que pueden ser larguísimas.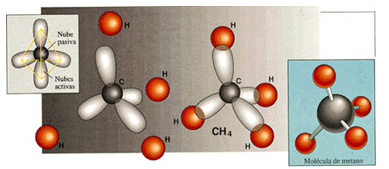 El ejemplo más simple de esto es un átomo de carbono que se une a tres hidrógenos y a otro carbono, que a su vez se une a otros tres hidrógenos. En este compuesto, de nombre etano, los dos carbonos actúan de forma tetragonal.
El ejemplo más simple de esto es un átomo de carbono que se une a tres hidrógenos y a otro carbono, que a su vez se une a otros tres hidrógenos. En este compuesto, de nombre etano, los dos carbonos actúan de forma tetragonal. 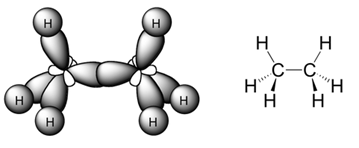 Enlace doble
Enlace doble : El carbono no tiene por qué formar los cuatro enlaces con cuatro átomos distintos. Puede darse el caso de que dos de esos enlaces los forme con un mismo átomo. Hablamos entonces de un enlace doble. Los dos electrones que le quedan al carbono se enlazan con otros dos átomos mediante enlaces simples. En este caso, el enlace doble y los dos simples apuntan a los vértices de un triángulo casi equilátero. Se dice que el carbono actúa de forma trigonal.
: El carbono no tiene por qué formar los cuatro enlaces con cuatro átomos distintos. Puede darse el caso de que dos de esos enlaces los forme con un mismo átomo. Hablamos entonces de un enlace doble. Los dos electrones que le quedan al carbono se enlazan con otros dos átomos mediante enlaces simples. En este caso, el enlace doble y los dos simples apuntan a los vértices de un triángulo casi equilátero. Se dice que el carbono actúa de forma trigonal. El ejemplo más simple es el etileno, en el que los dos carbonos comparten dos electrones entre sí y los otros dos que les quedan a cada uno los comparten con dos átomos de hidrógeno. La estructura es trigonal y plana.
El ejemplo más simple es el etileno, en el que los dos carbonos comparten dos electrones entre sí y los otros dos que les quedan a cada uno los comparten con dos átomos de hidrógeno. La estructura es trigonal y plana. 
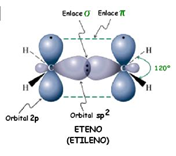 Enlace triple: Por último, puede el carbono formar tres enlaces con un mismo átomo, y el cuarto con un átomo distinto. Se habla entonces de un enlace triple. En este caso la molécula es lineal, y decimos que el carbono actúa de forma lineal.
Enlace triple: Por último, puede el carbono formar tres enlaces con un mismo átomo, y el cuarto con un átomo distinto. Se habla entonces de un enlace triple. En este caso la molécula es lineal, y decimos que el carbono actúa de forma lineal.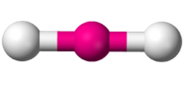 El ejemplo más simple de esto es el acetileno, en el que dos carbonos se unen mediante un enlace triple y el electrón que le queda a cada uno lo comparten con un átomo de hidrógeno. Por supuesto, la molécula es lineal.
El ejemplo más simple de esto es el acetileno, en el que dos carbonos se unen mediante un enlace triple y el electrón que le queda a cada uno lo comparten con un átomo de hidrógeno. Por supuesto, la molécula es lineal. 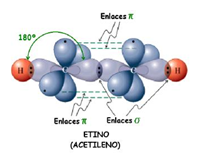
Los hidrocarburos son los compuestos orgánicos más sencillos. Están formados por cadenas de carbono unidos por enlaces simples, dobles o triples. El resto de los enlaces que quedan libres en estas cadenas se saturan con átomos de hidrógeno.
Las cadenas pueden tener también ramificaciones; así, un hidrocarburo de 4 carbonos puede tener la estructura del butano o la del metil-propano.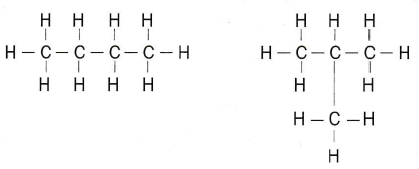 Ambas moléculas con C4H10, pero son compuestos distintos, con diferentes temperaturas de fusión y ebullición. A esta propiedad la llamamos isomería, y decimos que estas dos moléculas son isómeras de butano. Por esta razón, en química orgánica no son útiles las fórmulas moleculares que utilizamos en inorgánica, sino que es necesario indicar la estructura de las moléculas con fórmulas más desarrolladas
Ambas moléculas con C4H10, pero son compuestos distintos, con diferentes temperaturas de fusión y ebullición. A esta propiedad la llamamos isomería, y decimos que estas dos moléculas son isómeras de butano. Por esta razón, en química orgánica no son útiles las fórmulas moleculares que utilizamos en inorgánica, sino que es necesario indicar la estructura de las moléculas con fórmulas más desarrolladas
Los hidrocarburos son insolubles en agua, pero solubles en disolventes orgánicos como el alcohol, el benceno, el éter y otros hidrocarburos. Son menos densos que el agua.Arden combinándose con el oxígeno para formar dióxido de carbono y agua con un gran desprendimiento de calor, por lo que se utiliza como combustibles:C4H10 + 6,5 O2 ® 4 CO2 + 5 H2O + 2878’6 Kj/molSe clasifica en tres grandes grupos, dependiendo de los enlaces entre carbonos. Si solo hay enlaces simples, los llamamos saturados alcanos. Si hay algún enlace múltiple, insaturados; alquenos, si hay dobles enlaces, y alquinos, si hay triples.-Alcanos: a medida que aumenta el tamaño de la molécula, las temperaturas de ebullición aumentan también: del metano al butano son gases; del pentano al hexadecano, C16H14, líquidos, y el resto, sólidos. Químicamente son muy estables. Responden a la formula general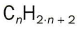 -Alquenos: debido al doble enlace, presentan una mayor reactividad química. Algunos son muy útiles para fabricar polímeros. Responden a la formula general
-Alquenos: debido al doble enlace, presentan una mayor reactividad química. Algunos son muy útiles para fabricar polímeros. Responden a la formula general 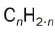 -Alquinos: son los más reactivos. Responden a la fórmula general
-Alquinos: son los más reactivos. Responden a la fórmula general 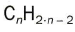
Para facilitar el estudio de la química del carbono, los compuestos se agrupan en grupos funcionales. Estos grupos engloban compuestos con estructuras similares, y por lo tanto, propiedades físicas y químicas muy parecidas. Los grupos funcionales son átomos o grupos de átomos unidos a cadenas de hidrocarburos alifáticas o aromáticas y es la zona de reactividad de las moléculas.Las reglas de nomenclatura de la IUPAC para los compuestos con diferentes grupos funcionales son semejantes, sólo se tiene que tomar en consideración el o los grupos presentes en las moléculas para indicar cuál es el sustituyente de un grupo funcional. 
¿Qué son? Su estructura es similar a la de los hidrocarburos, en los que se sustituye uno o más átomos de hidrógeno por grupos "hidroxilo", -OH. ¿Cómo se nombran?
SOLUBILIDAD EN EL AGUA: Gracias al grupo -OH característico de los alcoholes, se pueden presentar puentes de hidrógeno, que hace que los primeros alcoholes sean solubles en el agua, mientras que a mayor cantidad de hidrógeno, dicha característica va desapareciendo.PUNTO DE EBULLICION:En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones. Los cuatro primeros son líquidos, solubles en agua y olor suave; del C5 al C11 son líquidos aceitosos, insolubles en agua y olor agradable y el resto es sólidos, insolubles en agua y sin olor.PUNTO DE FUSION: Presenta el mismo comportamiento que el punto de ebullición, aumenta a medida que aumenta el número de carbonos.DENSIDAD: Aumenta conforme aumenta el número de carbonos y las ramificaciones de las moléculas.
El metanol es un compuesto químico, conocido como alcohol de madera o alcohol metílico. El metanol (a temperatura ambiente) es un líquido incoloro, volátil, tóxico e inflamable. Su olor suave a alcohol puede ser percibido a un umbral de concentración de 6,54 a 131 mg/m3 (5-100 ppm).Usos y aplicaciones del metanol El metanol posee diversas aplicaciones en diferentes industrias. Cuando es mezclado con el etanol, puede formarse uno de los compuestos químicos con mayor toxicidad para el consumo humano.Otro de sus usos es en la industria de bebidas, ya que se utiliza principalmente para la elaboración del vino.Este compuesto químico es un elemento clave para el destilado en seco de la madera, además de estar presente como materia prima en los productos de uso domestico (barnices, pintura de zapatos, limpiavidrios, solvente de lacas, etc.).El metanol es un disolvente industrial y se emplea como materia prima en la fabricación de formaldehido; se utiliza como anticongelante en vehículos, combustible de bombonas de camping-gas y disolvente de tintas.
Así se llama a la mezcla de etanol metanol; e utiliza como combustible (alcohol de quemar) y como disolvente. Se oxida por fermentación para formar acido etanoico o acético.En el laboratorio lo podemos obtener por destilación de un vino común
El alcohol etílico o etanol es un alcohol que se presenta como un líquido incoloro e inflamable con un punto de ebullición de 78 °C. Al mezclarse con agua en cualquier proporción, da una mezcla azeotrópica. Es un líquido transparente e incoloro, con sabor a quemado y un olor agradable característico. Es conocido sencillamente con el nombre de alcohol. Su fórmula química es CH3-CH2-OH, principal producto de las bebidas alcohólicas.El etanol es el alcohol que se encuentra en bebidas como la cerveza, la sidra, el vino y el brandy. Debido a su bajo punto de congelación, ha sido empleado como fluido en termómetros para medir temperaturas inferiores al punto de congelación del mercurio, -40 °C, y como anticongelante en radiadores de automóviles.El de uso comercial contiene un 95% en volumen de etanol y un 5% de agua.
Las industrias emplean con frecuencia el alcohol etílico en sus productos, por ejemplo como disolvente industrial, de pinturas, para barnices, para lacas.El etanol es muy utilizado en la preparación de bebidas alcohólicas, en los sectores farmacéuticos e industriales, la industria química lo utiliza como compuesto de partida en la síntesis de diversos productos, como el acetato de etilo, el éter dietílico también se utiliza en la elaboración de perfumes y ambientadores. Se emplea como combustible industrial y doméstico.
Son ácidos todos los compuestos que contienen en su molécula el grupo funcional carboxilo (-COOH), que solo se puede encontrar en los extremos de la cadena. El primer miembro de la serie es el ácido metanoico, H-COOH, que contiene un solo átomo de carbono
Se nombran con la palabra ácido seguida del nombre del hidrocarburo terminando en –oico. Algunos de ellos reciben nombres especiales
También llamado ácido fórmico, por encontrarse en las hormigas y otros insectos, así como en algunas plantas, como las ortigas. El dolor de la picadura de algunos insectos es debido al ácido, que queda bajo la piel Es un líquido incoloro de olor irritante que se emplea en la industria textil.
También se llama acido acético y se puede encontrar en las frutas y en algunas esencias.Se puede obtener por fermentación del etanol del vino, según la reacción: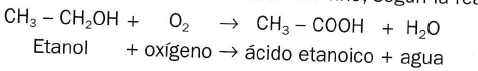 Este es un proceso de fermentación que se realiza por la acción de unas bacterias (Acetobacter). El vinagre contiene entre el 3 y el 6% de ácido acético junto con otras sustancias más complejas procedentes del vino.Es un líquido incoloro, muy soluble en agua y de olor penetrante.Se utiliza como reactivo y disolvente en la fábrica de acetatos (usados en las fibras artificiales) y otros productos, como fármacos, colorantes, etc.
Este es un proceso de fermentación que se realiza por la acción de unas bacterias (Acetobacter). El vinagre contiene entre el 3 y el 6% de ácido acético junto con otras sustancias más complejas procedentes del vino.Es un líquido incoloro, muy soluble en agua y de olor penetrante.Se utiliza como reactivo y disolvente en la fábrica de acetatos (usados en las fibras artificiales) y otros productos, como fármacos, colorantes, etc.
El nombre genérico de un importante grupo de sustancias orgánicas, que son también conocidas como hidratos de carbono.Son compuestos de carbono, oxígeno e hidrogeno, estando estos dos últimos en la misma proporción que en el agua.Los glúcidos son la principal fuente de energía de los seres vivos y forman parte de la estructura de sostén y de reserva energética de animales y plantas, como los azucares (glucosa y fructuosa) presentes en las frutas y sus polímeros: el almidón (semillas, tubérculos, rizomas, etc) y la lignina y celulosa (madera)La glucosa se produce en la fotosíntesis de las plantas por la unión del dióxido de carbono de la atmosfera y el agua con la aportación de la energía solar, de acuerdo con la siguiente reacción química:6 CO2 + 6 H2O + ENERGÍA -> C6H12O6 + 6 O2
Es el nombre genérico de distintos compuestos orgánicos formados por macromoléculas que contienen carbono, hidrógeno, oxígeno y nitrógeno como constituyentes principales. Están formadas por la unión de otros compuestos más sencillos, aminoácidos, que forman parte de todas las células animales y vegetales y del tejido de sostén, e intervienen en la regulación del metabolismo. Entre ellas podemos destacar: *La caseína de la leche. Se utiliza para fabricar queso y requesón, como complemento dietético para alimentos infantiles, pan, pastas o embutidos, y para obtener diversos productos, como plásticos, adhesivos, colas y pinturas. *El colágeno. Presente en la piel, tendones y cartílagos *La queratina. Forma y da rigidez a la estructura corneas *La hemoglobina de la sangre. Se encarga del transporte del oxígeno a los tejidos *La albúmina. Presente en la leche, la sangre y la clara del huevo
Los polímeros son macromoléculas que se forman por la unión de un gran número de moléculas sencillas, llamadas monómeros, formando largas cadenas, a veces redes.El número de monómeros que forman un polímero, en principio, no tiene límite. Los polímeros industriales pueden alcanzar masa moleculares de miles de u (Unidades de masa atómica). En la naturaleza forman parte de los seres vivos; es el caso de la celulosa o las proteínas. A los polímeros sintéticos se les da el nombre general de plásticos por la facilidad para moldearlos y poder darles formas muy variadas.
La polimerización es una reacción química por la cual los reactivos, monómeros (compuestos de bajo peso molecular), forman enlaces químicos entre sí, para dar lugar a una molécula de gran peso molecular (macromolécula), ya sea esta de cadena lineal o de estructura tridimensional, denominada polímero.
El polietileno tiene una excelente resistencia térmica y química y muy buena resistencia al impacto. Además, ofrece muy buena procesabilidad, es decir, se puede procesar por los métodos de conformados empleados para los termoplásticos, como inyección y extrusión.
Es un polímero obtenido de dos materias primas naturales cloruro de sodio o sal común (NaCl) (57%) y petróleo o gas natural (43%), siendo por lo tanto menos dependiente de recursos no renovables que otros plásticos. El PVC se presenta en su forma original como un polvo blanco, amorfo y opaco.Es uno de los polímeros más estudiados y utilizados por el hombre para su desarrollo y confort, dado que por su amplia versatilidad es utilizado en áreas tan diversas como la construcción, energía, salud, preservación de alimentos y artículos de uso diario, entre otros.
Los diferentes tipos de plásticos se englobas en tres grandes categorías: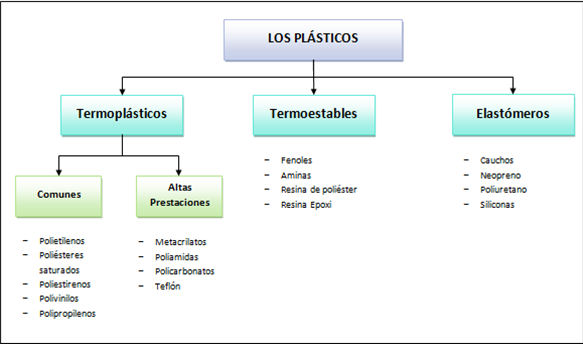 Polímeros termoplásticos son aquellos que se funden con el calor y se vuelven a endurecer con el frio.Polímeros termoestables son aquellos que no se reblandecen una vez que han sido moldeados.Los elastómeros, como su nombre indica, son elásticos y recuperan su forma primatica cuando cesa la presión.
Polímeros termoplásticos son aquellos que se funden con el calor y se vuelven a endurecer con el frio.Polímeros termoestables son aquellos que no se reblandecen una vez que han sido moldeados.Los elastómeros, como su nombre indica, son elásticos y recuperan su forma primatica cuando cesa la presión.
Los “plásticos” son hoy los materiales más utilizados en todos los órdenes de nuestra vida, hasta el punto de que algunos llaman a los siglos XX y XXI la “Edad de los Plásticos”, por similitud a la Edad de Piedra y la Edad de los Metales. En el año 1989, la producción mundial de plásticos superó a la producción de acero. Para 2010 la producción superara los 300 millones de toneladas al año.Esto hace nuestras vidas más confortables, pero al tratarse de sustancias químicamente muy estables, apenas se deterioran con el paso del tiempo, y se está generando un grave problema de contaminación medioambiental
Aproximadamente un 85% de los plásticos sintetizados son termoplásticos, entre los que se encuentran la mayoría de los que se utilizan como envases o embalajes, y existe la posibilidad de refundirlos a bajas temperaturas y volverlos a moldear. Si son recogidos de las basuras, por estar mezclados con papeles y otras impurezas, solo pueden fabricarse objetos de baja calidad como bancos, tablas, jardineras, contenedores, etc
Este proceso de reciclaje es una reacción química en la que se rompen las largas cadenas de polímeros en algunos monómeros para fabricar nuevos polímeros y otros gases para quemar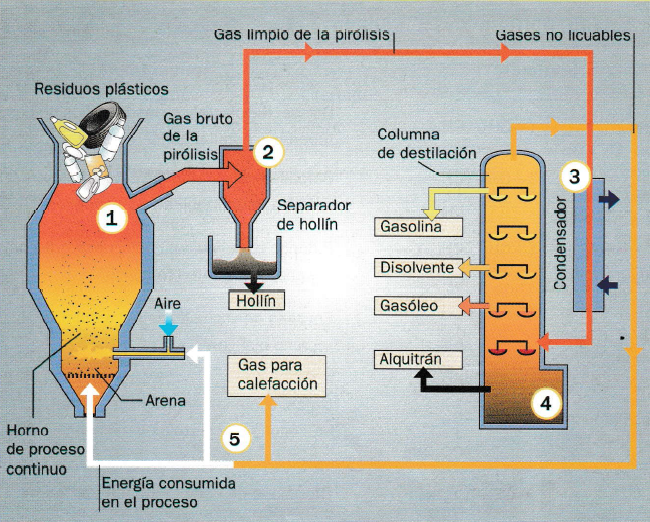
Es utilizar los plásticos como sustancias combustibles para recuperar la energía que contienen y utilizarla en otros procesos. Tiene la desventaja de que se producen gases de efecto invernadero, como CO2, y gases halogenados, muy tóxicos, con cloro, flúor, etc
Hoy se están investigando procedimientos para lograr que los plásticos puedan ser degradados por la naturaleza en menos tiempo. Para ello, se les añaden una seria de aditivos que acaban rompiendo sus largas moléculas. Los resultados obtenidos hasta ahora no son muy alentadores, aunque en algunos casos se ha logrado acortar unos años de su larga vida.
Es un nuevo tipo de polímeros que, en lugar de utilizar monómeros sencillos, como el etileno o el cloruro de vinilo, utilizan grandes moléculas de polímeros naturales, como el almidón. En lugar de obtenerse del petróleo, si materia prima es el maíz, el trigo o la patata, por tanto, cuan dejen de ser útiles y se les incinere, no habrá contaminación por CO2, ya que será el mismo que las plantas, en su día, tomaron de la atmosfera.Actualmente se está investigando para perfeccionarlos; no obstante, ya se fabrican algunos comercialmente, aunque todavía son caros y escasos, puesto que tiene propiedades diferentes de los anteriores y necesitan encontrar aplicaciones y mercado.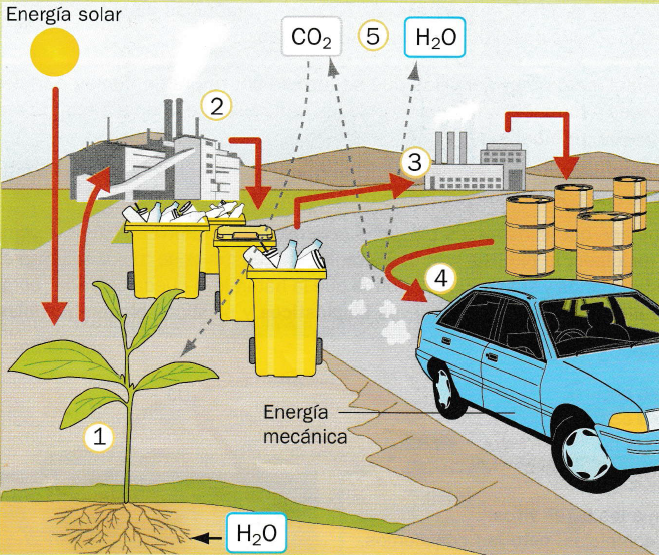
Este nuevo y revolucionario tipo de polímero podría ser una maravilla, algo así como una sustancia con dos vidas.La materia prima son los aceites vegetales, los mismos que se utilizan para el biodiesel. Al transformar químicamente los aceites se logran los polímeros. Una vez que han cumplido su función, para reciclarlos, se muelen y se ponen en agua templada, donde unas bacterias mutantes los transforman en biodiesel, que puede quemarse en vehículos o en centrales térmicas.Estas bacterias se obtienen por manipulación genética, introduciendo un gen procedente de un parásito que devora las hojas en la conocida bacteria Escherichia coli, que vive en nuestro intestino.Se produciría muy poca contaminación en todo el proceso
Categorías:
Etiquetas:
¿Quieres comentar? Regístrate o inicia sesión
Enhorabuena Rafael por tu Pan de Lección. Recuerda que, si lo deseas, puedes mejorarla incluyendo algún recurso de la colección sobre Compuestos de carbono en la sección de Para ampliar y Para Practicar
Añadir a Didactalia Arrastra el botón a la barra de marcadores del navegador y comparte tus contenidos preferidos. Más info...
Comentar
2