
Cargando...
Que pode fazer?
tipo de documento Lições

A pesar de que átomo significa ‘indivisible’, en realidad está formado por varias partículas subatómicas. El átomo contiene protones, neutrones y electrones, con la excepción del átomo de hidrógeno-1, que no contiene neutrones, y del catión hidrógeno o hidrón, que no contiene electrones. Los protones y neutrones del átomo se denominan nucleones, por formar parte del núcleo atómico.

Un átomo (del griego : ἄτομος, atomos , "indivisible") es la parte más pequeña de un elemento que puede existir en combinación con moléculas solas o similares . Consiste en el núcleo donde se encuentran los protones y neutrones y los electrones que lo rodean. El tamaño del núcleo de un átomo es 100.000 veces más pequeño que el tamaño del átomo completo; sin embargo, la mayor parte de la masa atómica está en el núcleo. Para darte una idea de las proporciones, si todo el átomo fuera un campo de fútbol, una lenteja colocada en el mediouno tendría el tamaño de un núcleo y todo el resto del espacio sería una nube electrónica.

Un protón es una partícula subatómica en el núcleo con carga eléctrica positiva. La cantidad de protones que tiene un átomo en su núcleo se llama número atómico . El número atómico determina el elemento químico , que condiciona muchas de las propiedades fisicoquímicas del elemento. Los elementos químicos se clasifican por número atómico en la tabla periódica.
La palabra protón proviene del griego ( πρῶτον ) y significa primero. Ernest Rutherford lo usó en 1920 para designar un núcleo de hidrógeno . El motivo fue que Rutherford, a través de colisiones atómicas, verificó que el núcleo de hidrógeno se podía obtener a partir del nitrógeno. A partir de esto, concluyó que el núcleo de hidrógeno era la base para la construcción de átomos más pesados, por lo que le dio al núcleo de hidrógeno el nombre de “primero”.

Un neutrón es una partícula subatómica con carga neutra (ni positiva ni negativa) con una masa similar a un protón , aproximadamente una unidad de masa atómica . se denota con la letra n . Fue descubierto por James Chadwick en 1932. Los protones y neutrones forman un núcleo atómico.
Los neutrones no afectan la configuración electrónica del átomo (la ubicación de los electrones alrededor del núcleo), pero definen la masa del átomo junto con los protones. De hecho, la masa del átomo (en unidades de masa atómica) se obtiene sumando el número de protones y neutrones en el núcleo.
Los átomos de un elemento químico con diferentes números de neutrones se denominan isótopos . El carbono estable (Carbono-12) tiene 6 neutrones, siendo los isótopos de este elemento Carbono-13 y Carbono-14 , por ejemplo, y estos isótopos tienen 7 y 8 neutrones, respectivamente.
Un electrón (del griego : ἤλεκτρον ḗlektron «ámbar») es una partícula subatómica. Tiene una sola carga eléctrica elemental negativa. La masa de un electrón es aproximadamente 1863 veces más pequeña que la de un protón.
Richard Laming formuló la primera hipótesis de una carga indivisible, intentando explicar las propiedades químicas de los átomos. El físico irlandés George Johnstone Stoney llamó a esta carga "electrón" en 1891 , y JJ Thomson y su equipo de físicos lo vieron como una partícula en 1897.
Los electrones afectan una variedad de fenómenos físicos, como la electricidad, el magnetismo la química y la conductividad térmica. También están involucrados en interacciones débiles, gravitacionales y electromagnéticas.
Los electrones tienen un impacto en muchas áreas, como la electrónica, la soldadura, los tubos de rayos catódicos, la microscopía electrónica, la radioterapia, los láseres, los detectores de ionización de gas y los aceleradores de partículas.

Una sustancia química es una clase particular de materia homogénea cuya composición es fija y químicamente definida. Se compone por las siguientes entidades: moléculas, unidades formulares y átomos.
Las sustancias se pueden clasificar en sustancia simple y sustancia compuesta.
Se nombra sustancia simple a aquella sustancia formada por átomos y moléculas de un solo elemento químico. Por ejemplo el oxígeno diatómico O2 formado solamente por el elemento oxígeno o el Fullereno C60 formado solo por el elemento carbono.
Se llama sustancia compuesto en el caso de que la sustancia este formado por elementos distintos. Ejemplo de ello puede ser el agua H2O porque esta formado por elementos como el hidrógeno y oxígeno, otro ejemplo es la glucosa C6H12O6 formada por carbono, hidrógeno y oxígeno.
En ningún caso se debe confundir sustancia con mezcla, ya que la mezcla es una porción de materia que contiene dos a más sustancias, y puede ser heterogénea u homogénea.
El modelo atómico es una representación estructural de un átomo que trata de explicar su comportamiento y propiedades.
 El modelo atómico de Dalton es el modelo atómico postulado por John Dalton en 1808 , el primero en ser formulado con base científica. No fue hasta un siglo después que se impuso otro modelo.
El modelo atómico de Dalton es el modelo atómico postulado por John Dalton en 1808 , el primero en ser formulado con base científica. No fue hasta un siglo después que se impuso otro modelo.
Dalton dijo que cada elemento químico está formado por átomos únicos y desiguales, y que estos no se pueden destruir ni modificar por medios químicos, sino que se pueden combinar para crear estructuras más complejas ( compuestos químicos ). Esta fue la primera teoría científica sobre el átomo, ya que Dalton concluyó sus teorías a través de la experimentación y el estudio de resultados.
En 1803, Dalton presentó oralmente su primera lista, en la que explicaba el peso atómico relativo de diferentes sustancias. Este artículo fue publicado en 1805, pero no explica exactamente cómo llegó a encontrar estas figuras. El método se publicó por primera vez en 1807 gracias a su amistad con Thomas Thomson en la tercera edición de A System of Chemistry de Thomson . Finalmente, Dalton describió el trabajo completo en uno de sus textos, Un nuevo sistema de filosofía química, en 1808 y 1810.
Sin embargo, Dalton no pensó que existieran algunos elementos atómicos en las moléculas
 Thomson modelo atómico J. J. Thomson en 1897 el electrón y en 1904 propuso el modelo atómico. Allí los electrones (que Thomson denominó "corpúsculos") están contenidos en un núcleo positivo como si fueran pasas en un pastel, como se muestra en la figura. Por este motivo, también se le conoce como el "modelo de pudín de ciruela" en inglés, que es algo parecido al bizcocho de pasas en euskera. Este modelo atómico se consideró real hasta el experimento de Rutherford.
Thomson modelo atómico J. J. Thomson en 1897 el electrón y en 1904 propuso el modelo atómico. Allí los electrones (que Thomson denominó "corpúsculos") están contenidos en un núcleo positivo como si fueran pasas en un pastel, como se muestra en la figura. Por este motivo, también se le conoce como el "modelo de pudín de ciruela" en inglés, que es algo parecido al bizcocho de pasas en euskera. Este modelo atómico se consideró real hasta el experimento de Rutherford.
Thomson tomó dos declaraciones como base de su trabajo, las cuales estaban relacionadas con lo que percibía a simple vista:
Thomson, sin embargo, a partir de su investigación, sabía que estos átomos deben tener otras partículas de naturaleza eléctrica negativa alrededor o dentro de ellos, a las que llamó electrones . Siendo así, el científico dijo que los átomos generalmente están compuestos por una masa de carga positiva y dentro de esta masa, adheridas, hay partículas más pequeñas con carga negativa, a saber, electrones.
Este modelo permitió explicar la electrificación por fricción, la presencia de partículas cargadas y las fuerzas entre cuerpos cargados, de la siguiente manera:
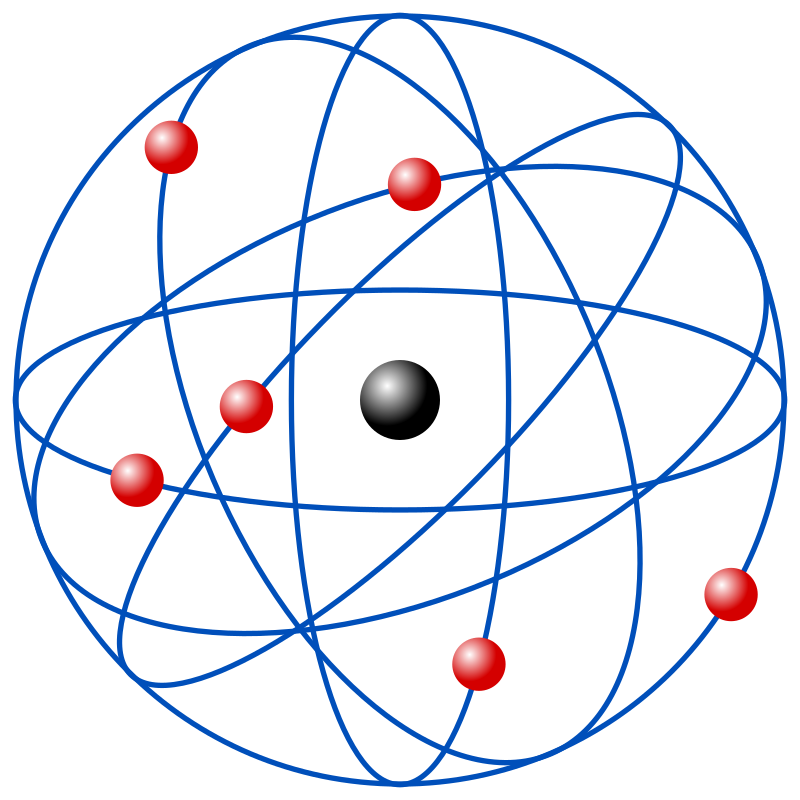 El modelo atómico de Rutherford es una teoría atómica formulada en 1911 por Ernest Rutherford . Reemplazó el modelo atómico propuesto de Thomson siete años antes .
El modelo atómico de Rutherford es una teoría atómica formulada en 1911 por Ernest Rutherford . Reemplazó el modelo atómico propuesto de Thomson siete años antes .
En un intento por establecer la verdadera estructura del átomo, en 1909 Ernest Rutherford realizó un experimento en placa de oro con sus colegas Hans Geiger y Ernest Mardsen . Bombardeó una hoja muy fina de oro con rayos alfa y estudió la desviación de estos rayos a través de una pantalla fluorescente. Aunque la desviación esperada fue de alrededor de 2º, en algunos casos la desviación fue mayor, así como casi 180º.
La formulación de este modelo atómico es la siguiente
 El modelo atómico de Bohr es un modelo atómico propuesto por Niels Bohr, basado en los resultados obtenidos en el experimento de la placa de oro de Rutherford . El modelo de Bohr, como el de Rutherford , es planetario, es decir, tiene un núcleo cargado positivamente en el centro, y los electrones , con su carga negativa, giran hacia ese núcleo. En lugar de fuerza gravitacional , mantiene la energía electrostática en su lugar. Basado en la naturaleza cuántica de la energía de Planck , Bohr propuso que las órbitas de los electrones son discretas, lo que significa que las órbitas de los electrones solo pueden contener ciertas energías.El seguidor del modelo atómico de Thomson y Rutherford habían propuesto anteriormente que una mejora del modelo atómico era a menudo también conocido como modelo atómico de Rutherford-Bohr.
El modelo atómico de Bohr es un modelo atómico propuesto por Niels Bohr, basado en los resultados obtenidos en el experimento de la placa de oro de Rutherford . El modelo de Bohr, como el de Rutherford , es planetario, es decir, tiene un núcleo cargado positivamente en el centro, y los electrones , con su carga negativa, giran hacia ese núcleo. En lugar de fuerza gravitacional , mantiene la energía electrostática en su lugar. Basado en la naturaleza cuántica de la energía de Planck , Bohr propuso que las órbitas de los electrones son discretas, lo que significa que las órbitas de los electrones solo pueden contener ciertas energías.El seguidor del modelo atómico de Thomson y Rutherford habían propuesto anteriormente que una mejora del modelo atómico era a menudo también conocido como modelo atómico de Rutherford-Bohr.
Bohr propuso su modelo en 1913 y su éxito llegó junto con la explicación de las líneas espectrales predichas por la fórmula de Rydberg para el hidrógeno. Antes del modelo de Bohr, la fórmula de Rydberg estaba probada experimentalmente, pero no podía explicarse teóricamente. La explicación de Bohr no solo proporcionó una base teórica para los resultados de la fórmula de Rydberg, sino que también demostró que había varias constantes físicas clave en la fórmula .
El modelo de Bohr es un modelo simple del átomo de hidrógeno, pero es válido para varios sistemas. Es por eso que ahora se muestra como una introducción a la mecánica cuántica en las escuelas, a pesar de que el modelo de Bohr en sí es una teoría científica obsoleta.
Texto:
Imagen:
A pesar de que átomo significa ‘indivisible’, en realidad está formado por varias partículas subatómicas. El átomo contiene protones, neutrones y electrones, con la excepción del átomo de hidrógeno-1, que no contiene neutrones, y del catión hidrógeno o hidrón, que no contiene electrones. Los protones y neutrones del átomo se denominan nucleones, por formar parte del núcleo atómico.

Un átomo (del griego : ἄτομος, atomos , "indivisible") es la parte más pequeña de un elemento que puede existir en combinación con moléculas solas o similares . Consiste en el núcleo donde se encuentran los protones y neutrones y los electrones que lo rodean. El tamaño del núcleo de un átomo es 100.000 veces más pequeño que el tamaño del átomo completo; sin embargo, la mayor parte de la masa atómica está en el núcleo. Para darte una idea de las proporciones, si todo el átomo fuera un campo de fútbol, una lenteja colocada en el mediouno tendría el tamaño de un núcleo y todo el resto del espacio sería una nube electrónica.

Un protón es una partícula subatómica en el núcleo con carga eléctrica positiva. La cantidad de protones que tiene un átomo en su núcleo se llama número atómico . El número atómico determina el elemento químico , que condiciona muchas de las propiedades fisicoquímicas del elemento. Los elementos químicos se clasifican por número atómico en la tabla periódica.
La palabra protón proviene del griego ( πρῶτον ) y significa primero. Ernest Rutherford lo usó en 1920 para designar un núcleo de hidrógeno . El motivo fue que Rutherford, a través de colisiones atómicas, verificó que el núcleo de hidrógeno se podía obtener a partir del nitrógeno. A partir de esto, concluyó que el núcleo de hidrógeno era la base para la construcción de átomos más pesados, por lo que le dio al núcleo de hidrógeno el nombre de “primero”.

Un neutrón es una partícula subatómica con carga neutra (ni positiva ni negativa) con una masa similar a un protón , aproximadamente una unidad de masa atómica . se denota con la letra n . Fue descubierto por James Chadwick en 1932. Los protones y neutrones forman un núcleo atómico.
Los neutrones no afectan la configuración electrónica del átomo (la ubicación de los electrones alrededor del núcleo), pero definen la masa del átomo junto con los protones. De hecho, la masa del átomo (en unidades de masa atómica) se obtiene sumando el número de protones y neutrones en el núcleo.
Los átomos de un elemento químico con diferentes números de neutrones se denominan isótopos . El carbono estable (Carbono-12) tiene 6 neutrones, siendo los isótopos de este elemento Carbono-13 y Carbono-14 , por ejemplo, y estos isótopos tienen 7 y 8 neutrones, respectivamente.
Un electrón (del griego : ἤλεκτρον ḗlektron «ámbar») es una partícula subatómica. Tiene una sola carga eléctrica elemental negativa. La masa de un electrón es aproximadamente 1863 veces más pequeña que la de un protón.
Richard Laming formuló la primera hipótesis de una carga indivisible, intentando explicar las propiedades químicas de los átomos. El físico irlandés George Johnstone Stoney llamó a esta carga "electrón" en 1891 , y JJ Thomson y su equipo de físicos lo vieron como una partícula en 1897.
Los electrones afectan una variedad de fenómenos físicos, como la electricidad, el magnetismo la química y la conductividad térmica. También están involucrados en interacciones débiles, gravitacionales y electromagnéticas.
Los electrones tienen un impacto en muchas áreas, como la electrónica, la soldadura, los tubos de rayos catódicos, la microscopía electrónica, la radioterapia, los láseres, los detectores de ionización de gas y los aceleradores de partículas.

Una sustancia química es una clase particular de materia homogénea cuya composición es fija y químicamente definida. Se compone por las siguientes entidades: moléculas, unidades formulares y átomos.
Las sustancias se pueden clasificar en sustancia simple y sustancia compuesta.
Se nombra sustancia simple a aquella sustancia formada por átomos y moléculas de un solo elemento químico. Por ejemplo el oxígeno diatómico O2 formado solamente por el elemento oxígeno o el Fullereno C60 formado solo por el elemento carbono.
Se llama sustancia compuesto en el caso de que la sustancia este formado por elementos distintos. Ejemplo de ello puede ser el agua H2O porque esta formado por elementos como el hidrógeno y oxígeno, otro ejemplo es la glucosa C6H12O6 formada por carbono, hidrógeno y oxígeno.
En ningún caso se debe confundir sustancia con mezcla, ya que la mezcla es una porción de materia que contiene dos a más sustancias, y puede ser heterogénea u homogénea.
El modelo atómico es una representación estructural de un átomo que trata de explicar su comportamiento y propiedades.
 El modelo atómico de Dalton es el modelo atómico postulado por John Dalton en 1808 , el primero en ser formulado con base científica. No fue hasta un siglo después que se impuso otro modelo.
El modelo atómico de Dalton es el modelo atómico postulado por John Dalton en 1808 , el primero en ser formulado con base científica. No fue hasta un siglo después que se impuso otro modelo.
Dalton dijo que cada elemento químico está formado por átomos únicos y desiguales, y que estos no se pueden destruir ni modificar por medios químicos, sino que se pueden combinar para crear estructuras más complejas ( compuestos químicos ). Esta fue la primera teoría científica sobre el átomo, ya que Dalton concluyó sus teorías a través de la experimentación y el estudio de resultados.
En 1803, Dalton presentó oralmente su primera lista, en la que explicaba el peso atómico relativo de diferentes sustancias. Este artículo fue publicado en 1805, pero no explica exactamente cómo llegó a encontrar estas figuras. El método se publicó por primera vez en 1807 gracias a su amistad con Thomas Thomson en la tercera edición de A System of Chemistry de Thomson . Finalmente, Dalton describió el trabajo completo en uno de sus textos, Un nuevo sistema de filosofía química, en 1808 y 1810.
Sin embargo, Dalton no pensó que existieran algunos elementos atómicos en las moléculas
 Thomson modelo atómico J. J. Thomson en 1897 el electrón y en 1904 propuso el modelo atómico. Allí los electrones (que Thomson denominó "corpúsculos") están contenidos en un núcleo positivo como si fueran pasas en un pastel, como se muestra en la figura. Por este motivo, también se le conoce como el "modelo de pudín de ciruela" en inglés, que es algo parecido al bizcocho de pasas en euskera. Este modelo atómico se consideró real hasta el experimento de Rutherford.
Thomson modelo atómico J. J. Thomson en 1897 el electrón y en 1904 propuso el modelo atómico. Allí los electrones (que Thomson denominó "corpúsculos") están contenidos en un núcleo positivo como si fueran pasas en un pastel, como se muestra en la figura. Por este motivo, también se le conoce como el "modelo de pudín de ciruela" en inglés, que es algo parecido al bizcocho de pasas en euskera. Este modelo atómico se consideró real hasta el experimento de Rutherford.
Thomson tomó dos declaraciones como base de su trabajo, las cuales estaban relacionadas con lo que percibía a simple vista:
Thomson, sin embargo, a partir de su investigación, sabía que estos átomos deben tener otras partículas de naturaleza eléctrica negativa alrededor o dentro de ellos, a las que llamó electrones . Siendo así, el científico dijo que los átomos generalmente están compuestos por una masa de carga positiva y dentro de esta masa, adheridas, hay partículas más pequeñas con carga negativa, a saber, electrones.
Este modelo permitió explicar la electrificación por fricción, la presencia de partículas cargadas y las fuerzas entre cuerpos cargados, de la siguiente manera:
 El modelo atómico de Rutherford es una teoría atómica formulada en 1911 por Ernest Rutherford . Reemplazó el modelo atómico propuesto de Thomson siete años antes .
El modelo atómico de Rutherford es una teoría atómica formulada en 1911 por Ernest Rutherford . Reemplazó el modelo atómico propuesto de Thomson siete años antes .
En un intento por establecer la verdadera estructura del átomo, en 1909 Ernest Rutherford realizó un experimento en placa de oro con sus colegas Hans Geiger y Ernest Mardsen . Bombardeó una hoja muy fina de oro con rayos alfa y estudió la desviación de estos rayos a través de una pantalla fluorescente. Aunque la desviación esperada fue de alrededor de 2º, en algunos casos la desviación fue mayor, así como casi 180º.
La formulación de este modelo atómico es la siguiente
 El modelo atómico de Bohr es un modelo atómico propuesto por Niels Bohr, basado en los resultados obtenidos en el experimento de la placa de oro de Rutherford . El modelo de Bohr, como el de Rutherford , es planetario, es decir, tiene un núcleo cargado positivamente en el centro, y los electrones , con su carga negativa, giran hacia ese núcleo. En lugar de fuerza gravitacional , mantiene la energía electrostática en su lugar. Basado en la naturaleza cuántica de la energía de Planck , Bohr propuso que las órbitas de los electrones son discretas, lo que significa que las órbitas de los electrones solo pueden contener ciertas energías.El seguidor del modelo atómico de Thomson y Rutherford habían propuesto anteriormente que una mejora del modelo atómico era a menudo también conocido como modelo atómico de Rutherford-Bohr.
El modelo atómico de Bohr es un modelo atómico propuesto por Niels Bohr, basado en los resultados obtenidos en el experimento de la placa de oro de Rutherford . El modelo de Bohr, como el de Rutherford , es planetario, es decir, tiene un núcleo cargado positivamente en el centro, y los electrones , con su carga negativa, giran hacia ese núcleo. En lugar de fuerza gravitacional , mantiene la energía electrostática en su lugar. Basado en la naturaleza cuántica de la energía de Planck , Bohr propuso que las órbitas de los electrones son discretas, lo que significa que las órbitas de los electrones solo pueden contener ciertas energías.El seguidor del modelo atómico de Thomson y Rutherford habían propuesto anteriormente que una mejora del modelo atómico era a menudo también conocido como modelo atómico de Rutherford-Bohr.
Bohr propuso su modelo en 1913 y su éxito llegó junto con la explicación de las líneas espectrales predichas por la fórmula de Rydberg para el hidrógeno. Antes del modelo de Bohr, la fórmula de Rydberg estaba probada experimentalmente, pero no podía explicarse teóricamente. La explicación de Bohr no solo proporcionó una base teórica para los resultados de la fórmula de Rydberg, sino que también demostró que había varias constantes físicas clave en la fórmula .
El modelo de Bohr es un modelo simple del átomo de hidrógeno, pero es válido para varios sistemas. Es por eso que ahora se muestra como una introducción a la mecánica cuántica en las escuelas, a pesar de que el modelo de Bohr en sí es una teoría científica obsoleta.
Texto:
Imagen:
Conteúdo exclusivo para membros de
Mira un ejemplo de lo que te pierdes
Categorias:
Etiquetas:
Deseja fazer um comentário? Registrar o Iniciar sessão
Si ya eres usuario, Inicia sesión
Adicionar ao Didactalia Arrastra el botón a la barra de marcadores del navegador y comparte tus contenidos preferidos. Más info...
Comente
0