
Cargando...
What can I do?
Una sustancia química es una clase particular de materia homogénea cuya composición es fija y químicamente definida. Se compone por las siguientes entidades: moléculas, unidades formulares y átomos.
A veces, la palabra sustancia se emplea con un sentido más amplio, para referirse a la clase de materia de la que están formados los cuerpos, aunque por lo general, en química el empleo de la palabra sustancia está restringido al sentido dado por la primera definición.
Las sustancias se pueden diferenciar una de otra por su estado a la misma temperatura y presión, es decir, pueden ser sólidas, líquidas o gaseosas. También se pueden caracterizar por sus propiedades físicas, como la densidad, el punto de fusión, el punto de ebullición y solubilidad en diferentes disolventes. Además estas distintas propiedades son específicas, fijas y reproducibles a una temperatura y presión dada.
Una sustancia no puede separarse en otras por ningún medio físico. Estas sustancias pueden clasificarse en dos grupos: sustancias simples y sustancias compuestas o compuestos. Las sustancias simples están formadas por átomos de un mismo tipo, es decir de un mismo elemento, y los compuestos están formados por dos o más tipos de átomos diferentes.
Toda sustancia puede sufrir tres tipos de cambios: físicos, fisicoquímicos y químicos. En los cambios físicos no hay ninguna transformación química de las sustancias, solo de su forma, por ejemplo, comprimir un gas o romper un sólido. En los cambios fisicoquímicos tampoco hay una transformación química, sino solo cambios de agregación, por ejemplo, fundir un metal o disolver sal en agua. Por último, cuando se lleva a cabo un cambio químico, una sustancia se transforma en otra totalmente diferente, como por ejemplo oxidar un alambre metálico, o cuando reacciona un ácido con un álcali.
Las sustancias se pueden clasificar en sustancia simple y sustancia compuesta.

Se nombra sustancia simple a aquella sustancia formada por átomos y moléculas de un solo elemento químico. Por ejemplo el oxígeno diatómico O2 formado solamente por el elemento oxígeno o el Fullereno C60 formado solo por el elemento carbono.
Se llama sustancia compuesto en el caso de que la sustancia este formado por elementos distintos. Ejemplo de ello puede ser el agua H2Oporque esta formado por elementos como el hidrógeno y oxígeno, otro ejemplo es la glucosa C6H12O6 formada por carbono, hidrógeno y oxígeno.
En ningún caso se debe confundir sustancia con mezcla, ya que la mezcla es una porción de materia que contiene dos a más sustancias, y puede ser heterogénea u homogénea.
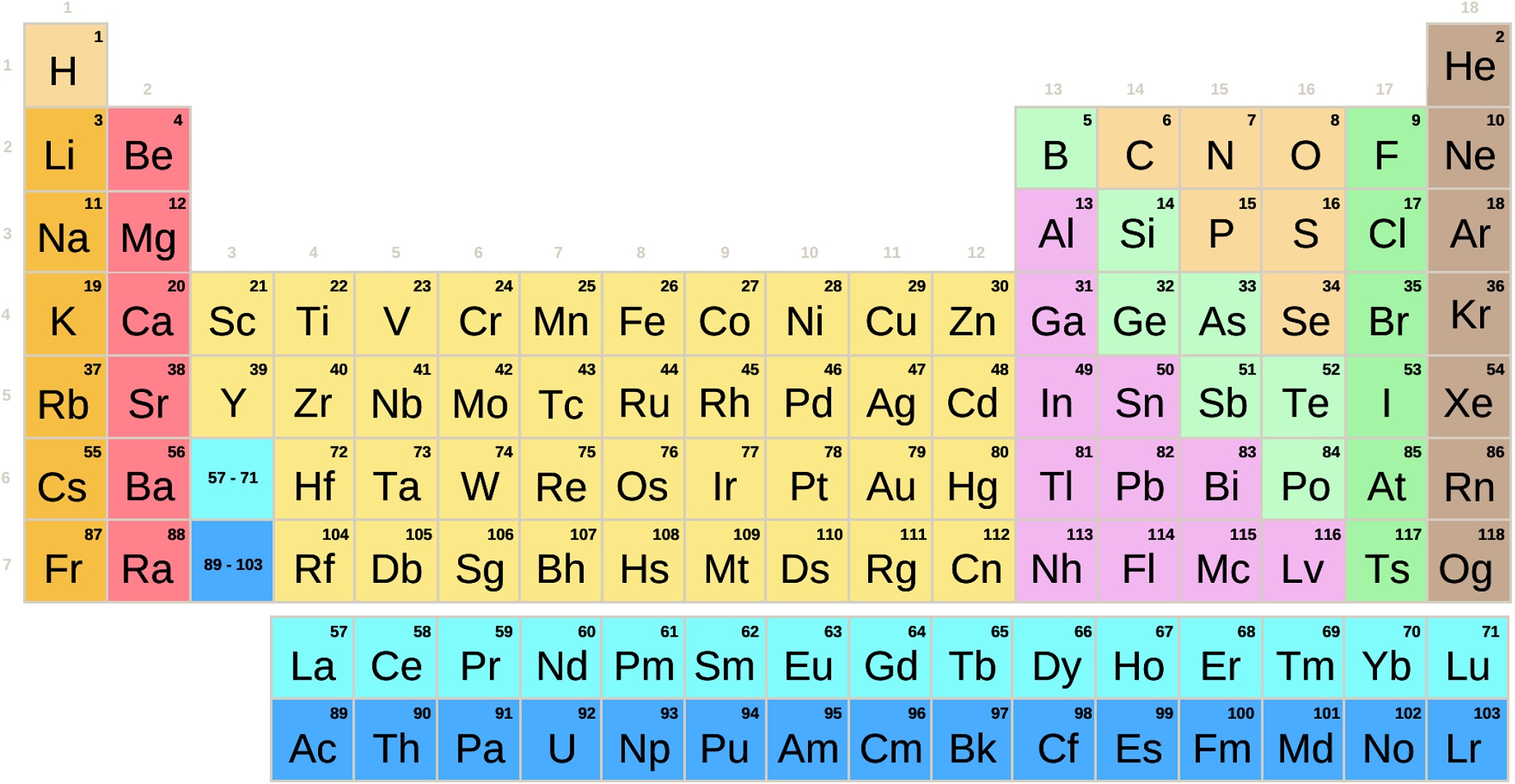
La tabla periódica de los elementos es una disposición de los elementos químicos en forma de tabla, ordenados por su número atómico (número de protones), por su configuración de electrones y sus propiedades químicas.
Este ordenamiento muestra tendencias periódicas como elementos con comportamiento similar en la misma columna.
En palabras de Theodor Benfey, la tabla y la ley periódica «son el corazón de la química —comparables a la teoría de la evolución en biología (que sucedió al concepto de la Gran Cadena del Ser), y a las leyes de la termodinámica en la física clásica—»
Las filas de la tabla se denominan períodos y las columnas grupos. Algunos grupos tienen nombres, así por ejemplo el grupo 17 es el de los halógenos y el grupo 18 el de los gases nobles. La tabla también se divide en cuatro bloques con algunas propiedades químicas similares. Debido a que las posiciones están ordenadas, se puede utilizar la tabla para obtener relaciones entre las propiedades de los elementos, o pronosticar propiedades de elementos nuevos todavía no descubiertos o sintetizados. La tabla periódica proporciona un marco útil para analizar el comportamiento químico y es ampliamente utilizada en química y otras ciencias.
Dmitri Mendeléyev publicó en 1869 la primera versión de tabla periódica que fue ampliamente reconocida, la desarrolló para ilustrar tendencias periódicas en las propiedades de los elementos entonces conocidos, al ordenar los elementos basándose en sus propiedades químicas, si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos.

Mendeléyev también pronosticó algunas propiedades de elementos entonces desconocidos que anticipó que ocuparían los lugares vacíos en su tabla. Posteriormente se demostró que la mayoría de sus predicciones eran correctas cuando se descubrieron los elementos en cuestión.

La tabla periódica de Mendeléyev ha sido desde entonces ampliada y mejorada con el descubrimiento o síntesis de elementos nuevos y el desarrollo de modelos teóricos nuevos para explicar el comportamiento químico. La estructura actual fue diseñada por Alfred Werner a partir de la versión de Mendeléyev. Existen además otros arreglos periódicos de acuerdo a diferentes propiedades y según el uso que se le quiera dar (en didáctica, geología, etc.). Para celebrar el 150 aniversario de su creación, la UNESCO declaró 2019 como el Año Internacional de la Tabla Periódica de los Elementos Químicos.
Se han descubierto o sintetizado todos los elementos de número atómico del 1 (hidrógeno) al 118 (oganesón); la IUPAC confirmó los elementos 113, 115, 117 y 118 el 30 de diciembre de 2015,10 y sus nombres y símbolos oficiales se hicieron públicos el 28 de noviembre de 2016. Los primeros 94 existen naturalmente, aunque algunos solo se han encontrado en cantidades pequeñas y fueron sintetizados en laboratorio antes de ser encontrados en la naturaleza.n. Los elementos con números atómicos del 95 al 118 solo han sido sintetizados en laboratorios. Allí también se produjeron numerosos radioisótopos sintéticos de elementos presentes en la naturaleza. Los elementos del 95 a 100 existieron en la naturaleza en tiempos pasados, pero actualmente no. La investigación para encontrar por síntesis nuevos elementos de números atómicos más altos continúa.
Texto:
Imagen:
Una sustancia química es una clase particular de materia homogénea cuya composición es fija y químicamente definida. Se compone por las siguientes entidades: moléculas, unidades formulares y átomos.
A veces, la palabra sustancia se emplea con un sentido más amplio, para referirse a la clase de materia de la que están formados los cuerpos, aunque por lo general, en química el empleo de la palabra sustancia está restringido al sentido dado por la primera definición.
Las sustancias se pueden diferenciar una de otra por su estado a la misma temperatura y presión, es decir, pueden ser sólidas, líquidas o gaseosas. También se pueden caracterizar por sus propiedades físicas, como la densidad, el punto de fusión, el punto de ebullición y solubilidad en diferentes disolventes. Además estas distintas propiedades son específicas, fijas y reproducibles a una temperatura y presión dada.
Una sustancia no puede separarse en otras por ningún medio físico. Estas sustancias pueden clasificarse en dos grupos: sustancias simples y sustancias compuestas o compuestos. Las sustancias simples están formadas por átomos de un mismo tipo, es decir de un mismo elemento, y los compuestos están formados por dos o más tipos de átomos diferentes.
Toda sustancia puede sufrir tres tipos de cambios: físicos, fisicoquímicos y químicos. En los cambios físicos no hay ninguna transformación química de las sustancias, solo de su forma, por ejemplo, comprimir un gas o romper un sólido. En los cambios fisicoquímicos tampoco hay una transformación química, sino solo cambios de agregación, por ejemplo, fundir un metal o disolver sal en agua. Por último, cuando se lleva a cabo un cambio químico, una sustancia se transforma en otra totalmente diferente, como por ejemplo oxidar un alambre metálico, o cuando reacciona un ácido con un álcali.
Las sustancias se pueden clasificar en sustancia simple y sustancia compuesta.

Se nombra sustancia simple a aquella sustancia formada por átomos y moléculas de un solo elemento químico. Por ejemplo el oxígeno diatómico O2 formado solamente por el elemento oxígeno o el Fullereno C60 formado solo por el elemento carbono.
Se llama sustancia compuesto en el caso de que la sustancia este formado por elementos distintos. Ejemplo de ello puede ser el agua H2Oporque esta formado por elementos como el hidrógeno y oxígeno, otro ejemplo es la glucosa formada por carbono, hidrógeno y oxígeno.
En ningún caso se debe confundir sustancia con mezcla, ya que la mezcla es una porción de materia que contiene dos a más sustancias, y puede ser heterogénea u homogénea.
La tabla periódica de los elementos es una disposición de los elementos químicos en forma de tabla, ordenados por su número atómico (número de protones), por su configuración de electrones y sus propiedades químicas.
Este ordenamiento muestra tendencias periódicas como elementos con comportamiento similar en la misma columna.
En palabras de Theodor Benfey, la tabla y la ley periódica «son el corazón de la química —comparables a la teoría de la evolución en biología (que sucedió al concepto de la Gran Cadena del Ser), y a las leyes de la termodinámica en la física clásica—»
Las filas de la tabla se denominan períodos y las columnas grupos. Algunos grupos tienen nombres, así por ejemplo el grupo 17 es el de los halógenos y el grupo 18 el de los gases nobles. La tabla también se divide en cuatro bloques con algunas propiedades químicas similares. Debido a que las posiciones están ordenadas, se puede utilizar la tabla para obtener relaciones entre las propiedades de los elementos, o pronosticar propiedades de elementos nuevos todavía no descubiertos o sintetizados. La tabla periódica proporciona un marco útil para analizar el comportamiento químico y es ampliamente utilizada en química y otras ciencias.
Dmitri Mendeléyev publicó en 1869 la primera versión de tabla periódica que fue ampliamente reconocida, la desarrolló para ilustrar tendencias periódicas en las propiedades de los elementos entonces conocidos, al ordenar los elementos basándose en sus propiedades químicas, si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos.

Mendeléyev también pronosticó algunas propiedades de elementos entonces desconocidos que anticipó que ocuparían los lugares vacíos en su tabla. Posteriormente se demostró que la mayoría de sus predicciones eran correctas cuando se descubrieron los elementos en cuestión.

La tabla periódica de Mendeléyev ha sido desde entonces ampliada y mejorada con el descubrimiento o síntesis de elementos nuevos y el desarrollo de modelos teóricos nuevos para explicar el comportamiento químico. La estructura actual fue diseñada por Alfred Werner a partir de la versión de Mendeléyev. Existen además otros arreglos periódicos de acuerdo a diferentes propiedades y según el uso que se le quiera dar (en didáctica, geología, etc.). Para celebrar el 150 aniversario de su creación, la UNESCO declaró 2019 como el Año Internacional de la Tabla Periódica de los Elementos Químicos.
Se han descubierto o sintetizado todos los elementos de número atómico del 1 (hidrógeno) al 118 (oganesón); la IUPAC confirmó los elementos 113, 115, 117 y 118 el 30 de diciembre de 2015,10 y sus nombres y símbolos oficiales se hicieron públicos el 28 de noviembre de 2016. Los primeros 94 existen naturalmente, aunque algunos solo se han encontrado en cantidades pequeñas y fueron sintetizados en laboratorio antes de ser encontrados en la naturaleza.n. Los elementos con números atómicos del 95 al 118 solo han sido sintetizados en laboratorios. Allí también se produjeron numerosos radioisótopos sintéticos de elementos presentes en la naturaleza. Los elementos del 95 a 100 existieron en la naturaleza en tiempos pasados, pero actualmente no. La investigación para encontrar por síntesis nuevos elementos de números atómicos más altos continúa.
Texto:
Imagen:
Exclusive content for members of
Mira un ejemplo de lo que te pierdes
Categories:
Tags:
Add to Didactalia Arrastra el botón a la barra de marcadores del navegador y comparte tus contenidos preferidos. Más info...
Comment
0